- Noticias / El multiverso del factor de crecimiento similar a la insulina
CEDIE y sociedad: Espacio de Divulgación Científica a la Sociedad
El multiverso del factor de crecimiento similar a la insulina
Por María Celia Fernández
Compartir en
redes sociales
"El Multiverso es un concepto del cual sabemos inquietantemente poco" le dice el Dr. Stephen Strange a Peter Parker (el Hombre Araña). El Multiverso de Marvel Comics al que pertenecen el Dr. Strange, el Hombre Araña y otros personajes, es el agregado de todas las dimensiones y realidades paralelas en existencia. Aunque las dimensiones son sólo porciones de la realidad dentro de un universo, también existen universos paralelos que coexisten entre sí. Es decir que, según Marvel Comics, existirían muchos universos además del que uno conoce. Si pensamos en la Ciencia, advertimos que esta definición podría aplicarse casi de manera perfecta. La ciencia engloba numerosas áreas (universos) en las que coexisten diferentes disciplinas (dimensiones) que interactúan entre sí y que pueden desarrollarse de manera paralela. Y a medida que la ciencia descubre nuevas estrellas generadoras de estos universos, estos pueden conectarse entre sí, constituyendo y modificando el universo “conocido” dentro de la disciplina. En esta oportunidad les acercamos algunos de los descubrimientos que abren multiversos en la endocrinología, particularmente relacionados con el factor de crecimiento similar a la insulina o IGF (Insulin-like Growth Factor).
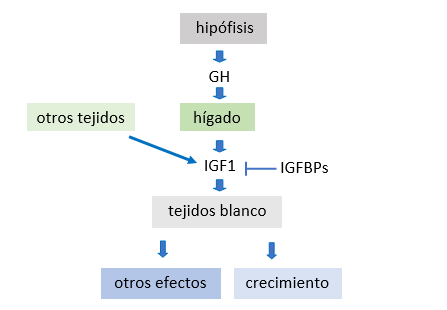
Hace más de 6 décadas, en 1957, los Drs. Salmon y Daughaday identificaron una sustancia que se encontraba en la sangre y que en experimentos de cultivo celular era capaz de estimular la incorporación de sulfatos al cartílago, a la que llamaron factor de sulfatación. Luego de este descubrimiento se abrieron varios universos, en los cuales este factor generaba efectos metabólicos además de los inicialmente demostrados sobre la sulfatación incluyendo tejidos más allá del cartílago descripto en un principio. Trece años más tarde el Dr. Daughaday propuso renombrar “somatomedinas” a esta sustancia como un término más general, con el prefijo “somato” denotando tanto la relación hormonal con la somatotropina (hormona de crecimiento o Growth Hormone, GH) como con el soma (haciendo referencia al cuerpo humano); y con el sufijo “medina” indicando que es intermediario de las acciones de la somatotropina. Así, se postuló que en el “eje somatotrófico” la GH producida por la hipófisis se libera a la sangre, actúa sobre el hígado -su principal órgano blanco- “diciéndole” que produzca somatomedina. Y la somatomedina, liberada al torrente sanguíneo actuando sobre los órganos blanco, promovía el aumento de la estatura. De esta manera la somatomedina se convertía en el mediador de las acciones de GH.
Transcurrieron varios años y controversias hasta que se pudo demostrar que la GH tiene, además, efectos directos sobre otros tejidos. A fines de la década del 70, investigando cómo era la estructura proteica de la somatomedina se comprobó que la sustancia descripta originalmente comprendía 2 polipéptidos (proteínas pequeñas) con estructura similar a la de la insulina, por lo que se los denominó factores de crecimiento similares a la insulina o IGFs (Insulin-like Growth Factors). Dada la similitud estructural y biológica de ambos factores, se los denominó IGF1 e IGF2.
También se comprobó que otras proteínas actuaban en conjunto con los IGFs, por lo que se habla del sistema de los IGFs. A esta familia o sistema pertenecen varios miembros con características y funciones diversas. Por un lado, los IGFs (IGF1 e IGF2) liberados a la sangre desde el hígado, también se producen en todos los tejidos del cuerpo, y para ejercer sus acciones se unen a receptores llamados IGF1R e IGF2R. Estos receptores se expresan en la amplia mayoría de las células del organismo. Los IGFs circulan en sangre unidos a otras proteínas denominadas proteínas de unión de IGFs o IGFBPs (IGF Binding Proteins) que sirven tanto para su transporte como para la modulación de sus efectos biológicos. Varios estudios demostraron la importancia de los IGFs en el crecimiento pre y post natal, pero no fue hasta en la década de los 90 que, gracias a la ingeniería genética y la posibilidad de manipular genes en animales, se demostró que animales que no podían producir IGF1 en el hígado (el órgano que más IGF1 libera a la sangre) crecían igual que los normales. De esto se dedujo que el IGF1 producido en cada tejido del cuerpo es suficiente para el desarrollo y crecimiento normal.
Este hallazgo abrió otro nuevo universo en el cual el IGF1 era la estrella central. Los estudios clínicos e investigaciones experimentales llevadas a cabo en este mismo período dieron cuenta de la relación entre los IGFs y el riesgo de padecer tumores, lo cual derivó en el desarrollo de universos paralelos: uno a favor y otro en contra de la supresión de la acción de los IGFs. Por ejemplo, varios tipos de cáncer presentan un aumento de IGF1R que se correlaciona con una mayor agresividad de la enfermedad, por lo que una disminución podría ser beneficiosa. Sin embargo, la similitud con la insulina complejizó el uso de inhibidores específicos del IGF1R como terapia. En este sentido, se intenta aún en la actualidad desenmascarar las posibles diferencias que puedan existir entre la insulina y el IGF1 en el complejo entrecruzamiento de señales intracelulares que los dos entretejen para llevar a cabo sus efectos metabólicos. Más evidencias a favor de la supresión de los IGFs se vio en animales con disminución de algunos de los componentes del eje GH/IGF1 (como deficiencia parcial del IGF1R o deficiencia en IGF1/ receptor de GH), en los cuales junto con la reducción de la acción de los IGFs se documentó una extensión de la vida y una resistencia a la aparición de cáncer. Por otro lado, y en contra de la supresión de los IGFs, en los humanos las mutaciones que disminuyen mucho la actividad de IGF1 provocan varias complicaciones clínicas como retraso mental, sordera, y otras características, además de la marcada baja talla. Asimismo, se demostró en animales que la anulación completa del IGF1R es incompatible con la vida, de lo que se deduce que se requiere un equilibrio y regulación muy precisa de este sistema para un normal desarrollo general.
Otros universos derivaron del estudio de las proteínas de transporte y sus funciones más allá de la clásica función de unir y transportar a los IGFs, y de los receptores, que además de estar en la superficie de las células, pueden encontrarse en el núcleo celular e interaccionar con el material genético. Por último, y por primera vez, muy recientemente se ha demostrado que el IGF1 puede iniciar procesos tumorales en el sistema nervioso central (más específicamente en la glia).
Pasaron más de 60 años desde la primera descripción de los factores de crecimiento similares a la insulina, y dada la multiplicidad de universos que se generan con el avance del conocimiento sobre su papel en procesos biológicos tanto normales como tumorales, la familia de los IGFs sigue intrigando y por ende estimulando a la comunidad científica, hasta el día de hoy, a descubrir nuevas dimensiones que impacten en el universo en que vivimos.
Autor: María Celia Fernández
Grupo: Laboratorio Factores de Crecimiento y Biología Tumoral
Editores: Mariana Tellechea, Ana Chiesa, María Noel Galardo, Héctor Jasper, Patricia Pennisi
Consejo Editorial "CEDIE y Sociedad"
* No se pretende infringir derechos de autor. La figura es una representación meramente ilustrativa.